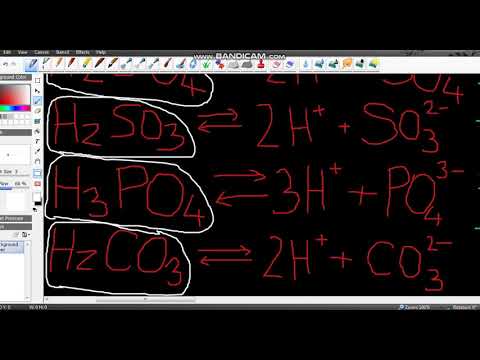
Према Бронстед-Ловри теорији киселина и база, молекул киселине донира један протон молекули воде, стварајући Х3О + јон и негативно наелектрисан јон познат као "коњугирана база". Док киселине као што су сумпорна (Х2СО4), карбонска (Х2ЦО3) и фосфорна (Х3ПО4) имају више протона (тј. Атома водоника) које треба давати, сваки донирани протони се рачунају као посебан пар база-коњугата. На пример, фосфорна киселина има само једну коњугирану базу: дихидроген фосфат (Х2ПО4-). У међувремену, хидроген фосфат (ХПО4 2-) је коњугирана база дихидроген фосфата, а фосфат (ПО4 3-) је коњугирана база хидроген фосфата.
Пребројите укупан број атома водоника у киселини.
Избројите молекул киселине укупан број набоја (набој јонског молекула изражава се као цели број, праћен позитивним или негативним предзнаком). Због тога би молекул хидроген фосфата (ХПО4 2-) имао набој "-2", док би молекул фосфорне киселине (Х3ПО4) имао набој "0".
Одузимите "1" од укупног броја атома водоника. На пример, ако сумпорна киселина има два водоника, тада ће њена коњугирана база имати само један атом водоника.
Додајте "-1" укупном набоју молекула. Дакле, ако кисели хидроген сулфат има набој "-1", његова коњугирана база ће имати набој "-2".