
Садржај
Да би просто израчунали, хемичари су направили стандардну јединицу за број атома одређеног једињења која је укључена у реакцију или неки други хемијски процес. Они дефинишу један мол (мол) као количину било које материје која има исти број основних јединица као 12 грама угљеника-12, што је Авогадрос број (6.022 × 1023). СИ (метрички) систем мерења дефинише милимоле (Ммол) као хиљадину мола. Број молова неке материје обично израчунавате тако да одмерите количину која имате у руци. Ако желите претворити у Ммол, помножите са 103 (1,000).
ТЛ; ДР (Предуго; нисам прочитао)
Један мол једнак је Авогадрос броју честица одређеног једињења. Милимола (Ммол) је хиљадина мола.
Како израчунати молове
Атомске масе се мере у јединицама атомске масе (АМУ). Једна АМУ је тачно 1/12 масе нуклеуса атома угљеника-12 у његовом основном стању. Један мол супстанце је дефинисан тако да је једнак Авогадрос броју честица те материје. Према овој дефиницији, тежина једног мола материје у грамима једнак је броју појединачне честице те супстанце у АМУ. На пример, атомска тежина угљеника-12 износи 12 АМУ, тако да један мол угљеника-12 тежи 12 грама.
Размотрите посуду пуну водоника (Х)2). Свака честица у посуди је молекул који се састоји од два атома водоника, тако да вам је потребна само атомска маса водоника да бисте израчунали молекулску масу. Већина верзија периодичне табеле наводи атомску масу сваког елемента под његовим симболом. За водоник, који у свом језгру има само један протон, износи 1.008 АМУ, што је просек свих изотопа водоника у природним условима. Сходно томе, атомска маса водоничног гаса је 2.016 АМУ, а један мол водоник-гаса тежи 2.016 грама. Да бисте пронашли број молова у вашем узорку, извагали бисте узорак у грамима и поделили ту тежину на молекуларну тежину гаса водоника у грамима. На пример, узорак тежак 15 грама чистог водоничног гаса садржи 7,44 мола.
Претварање у Ммол
Понекад су количине под истрагом толико мале да их је изражавање у моловима незгодно. Унесите милимоле. Умноживши број молова на хиљаду, врло мали број можете претворити у управљивији. Ово је нарочито погодно када се раде са јединицама запремине редоследом милилитара.
1 мол = 1.000 Ммола
Концентрација раствора
Хемичари користе моларност као меру концентрације одређеног једињења у раствору. Они дефинирају моларност као број молова по литри. Моларност претворите у милимоларност множењем са 1.000. На пример, 1 мол (моларни, такође написан као М) раствор има концентрацију од 1 мола по литру. То је еквивалент отопини од 1.000 Ммола (милимоларна, која се такође понекад назива и мМ), која садржи 1.000 Ммола по литри.
Пример
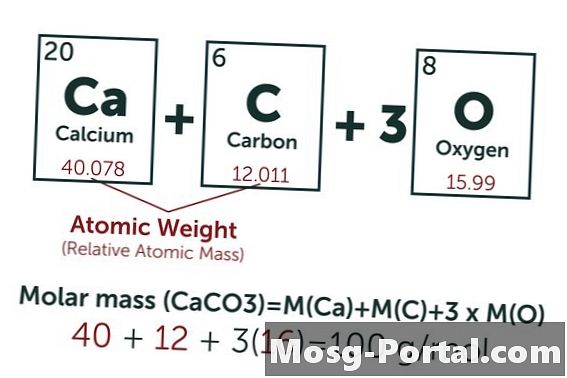
Раствор садржи 0,15 грама калцијумовог карбоната. Колико је то милимола?
Хемијска формула калцијум-карбоната је ЦаЦО3. Атомска тежина угљеника (Ц) је око 12 АМУ, тежина кисеоника (О) отприлике 16 АМУ, а тежина калцијума (Ца) приближно 40 АМУ. Сваки молекул калцијум-карбоната тежи 100 АМУ, што значи да један мол тежи приближно 100 грама. Тежина 0,15 грама представља 0,15 г ÷ 100 г / мол = 0,0015 молова. То је еквивалент 1,5 Ммол.
Колика је моларност и милимоларност овог много калцијум карбоната у 2,5 литре раствора?
Моларитет је дефинисан као број молова по литри, па поделите број молова на 2,5 да бисте добили моларитет: 0.0015 ÷ 2.5 =
0.0006 М
Помножите са 1.000 да бисте добили милимоларност =
0,6 мМ
Имајте на уму да ћете добити исти резултат за милимоларност ако број милимола поделите на запремину раствора.